Основные типы химической связи
Основные типы химической связи
Важным для понимания особенностей строения кристаллических структур является понятие об атомных или ионных радиусах. Атомный, ионный радиус (или радиуса иона) равен минимальному расстоянию, на которое центр сферы данного атома (иона) может приблизиться к поверхности сфер соседних атомов (ионов).
Величина радиуса иона (аниона или катиона) зависит от величины и знака заряда данного иона. Это можно сформулировать в виде следующего правила: чем больше положительный заряд иона, тем меньше его радиус; чем больше отрицательный заряд иона, тем больше его радиус. Следовательно, ионные радиусы катионов, как правило, будут меньше радиусов анионов, а радиус одного и того же элемента в различных степенях окисления будет также различным. Эти закономерности отчетливо прослеживаются на периодической таблице химических элементов Д.И. Менделеева. Размер радиуса одного и того же атома или иона может изменяться в определенных пределах в зависимости от ряда причин, главнейшей из которых является природа химической связи.
По современным представлениям, химическая связь является результатом движения электронов внешних (валентных) оболочек в пространстве между ядрами взаимодействующих атомов. Возникновение связи обуславливается тем, что электроны, которые принадлежат двум различным атомам, становятся для них общими.
Главнейшими типами связи, развитыми в кристаллах, являются металлические, ионные, ковалентные, ван-дер-ваальсовы и водородные.
Металлическая связь характерна для элементов первых групп периодической системы и интерметаллов. Эта связь осуществляется взаимодействием свободных электронов и положительно заряженных атомных ядер. Металлический кристалл можно представить как решетку из положительно заряженных атомных ядер, погруженных в отрицательно заряженный «газ», состоящий из свободных электронов. Все атомы отдают свои электроны в общее пользование, т. е. все свободные электроны обобществляются и легко перемещаются внутри структуры, не нарушая типа химической связи. Таким образом, в достаточно хорошем приближении металлическая связь может рассматриваться как сферически симметричная, не обладающая свойством направленности, т. е. изотропная. Модели структур с металлической связью строятся из атомов одинакового или близкого размера (радиусов), уложенных наиболее компактным образом. В результате этого каждый атом стремится окружить себя максимальным числом ближайших соседей. Поэтому для металлических структур характерны большие координационные числа (КЧ = 8, 12), плотные и плотнейшие упаковки частиц, а также ряд специфических свойств, таких как высокае электропроводность и теплопроводность, ковкость, невысокие температуры плавления и кипения, объясняемые существованием свободно перемещающихся электронов, слабо связанных с атомными ядрами металлов.
Ионная (гетерополярная) связь между различными по свойствам атомами, например между металлами и галогенами, осуществляется силами электростатического взаимодействия (притяжения) между разноименными «положительными» и «отрицательными» ионами - катионами и анионами, равномерно распределенными в кристаллическом пространстве ионного кристалла. В этом и заключается сущность ионной связи.
Например, Nа имеет единственный валентный электрон на своей внешней оболочке, который он легко отдает, оставляя атом с положительным несбалансированным зарядом. С другой стороны, Сl и другие элементы VII группы периодической таблицы могут легко приобретать устойчивую благородно-газовую оболочку, захватывая электрон для заполнения единственной вакансии на внешней электронной оболочке. Так возникают ионы с отрицательными несбалансированными зарядами. Ионы с избытком положительного заряда называются катионами, с избытком отрицательного заряда — анионами. В кристалле NaCl атом Nа переходит в ионное состояние (Na+), теряя электрон, а атом Сl ионизируется (Сl-), приобретая электрон.
Для структур с ионным типом связи характерны достаточно высокие координационные числа (КЧ = 6, 8), нередки плотнейшие упаковки атомов. Симметрия ионных кристаллов обычно высокая.
Для кристаллических веществ с ионным типом связи (например, NаСl, СsС1, СаF2 и др.) обычно характерны диэлектрические свойства, хрупкость, средние значения твердости и плотности, низкая тепло- и электропроводность.
Принято считать, что химическая связь у подавляющего большинства неорганических соединений носит ионный характер. При этом помимо структур, где ионная связь осуществляется между ионами отдельных химических элементов, широко распространены кристаллические структуры с подобным типом связи, которая реализуется между сложными ионами (радикалами), состоящими из атомов нескольких элементов: тетраэдрическими группами — [SO4]2-, [Р04]3-, [В04]5-, [Аs04]3-, [W04]2-, [SiO4]4-, плоскими группами - [С03]2-, [В03]3-, [N03]3- и т.д. И хотя в этих структурах ионные связи комбинируются с ковалентными, основные электростатические, пространственные и энергетические их особенности почти те же, что и в «простых» ионных соединениях. Например, структуру кальцита Са[С03] можно рассматривать как производную от структуры галита [NaCl] где позиции ионов Nа+ заняты ионами Са2+, положение групп [С03]2- соответствует положениям ионов Сl-.
Следует, однако, оговорить, что идеально ионных соединений в природе не существует. Поэтому такие соединения лучше называть преимущественно ионными.
Ковалентная (гомеополярная) связь возникает между одинаковыми или близкими по свойствам атомами и осуществляется с помощью обобществленных (принадлежащих одновременно двум атомам) пар электронов с противоположно направленными спинами - поделенной пары электронов - при наличии области перекрывания атомных орбиталей. При этом каждый из атомов приобретает стабильную конфигурацию благородно-газовых элементов. Например, одиночный атом Сl с вакансией на своей валентной оболочке очень активен. Если его ближайшим соседом оказывается другой атом хлора, они объединяются таким образом, что один электрон выполняет двойную функцию на внешних валентных оболочках обоих атомов, формируя у них заполненные внешние электронные оболочки (рисунок). Такой способ образования ковалентной связи, когда каждый атом отдает по одному электрону, называется обменным, а сама связь - одинарной ковалентной связью.
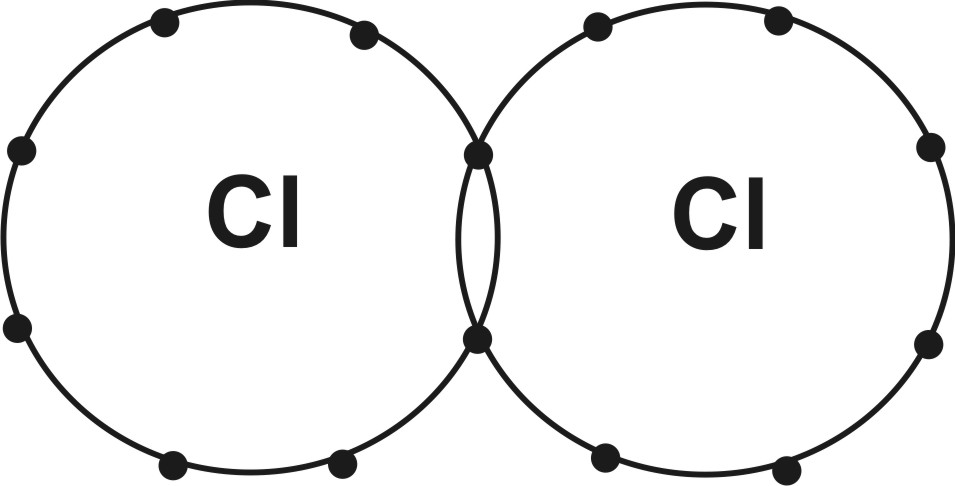
Ковалентная связь в молекуле С12
Ряд элементов (С, Si, S и др.) имеют не одну, а две, три, четыре вакансии на внешней электронной оболочке. И, следовательно, не вся энергия связи насыщается присоединением одного ближайшего атома. Поэтому такие элементы стремятся объединиться ковалентной связью с несколькими соседними атомами, образуя стабильные группы строго фиксированной формы. Количество общих электронных пар в ковалентной связи называется кратностью связи. Например, атомы С в структуре алмаза имеют четыре вакансии, которые заполняются обобществлением электронов с четырьмя соседними атомами С, вследствие чего образуется стабильная конфигурация в форме тетраэдра (КЧ = 4).
Ван-дер-ваальсова связь. Структуры с этим типом связи состоят из нейтральных изолированных или связанных в группы атомов - молекул. В качестве примера можно привести молекулярную структуру Сl2, в которой нейтральные молекулы Сl2 могут иметь незначительный избыток положительного заряда на одном конце с соответствующим недостатком на другом ее конце. Такие молекулы взаимодействуют как слабо заряженные диполи с разным зарядом на противоположных концах. Ориентировка соседних диполей все время изменяется. Однако во всех случаях диполи притягиваются, так как на их ближних участках всегда будет избыток отрицательного заряда с одной стороны и недостаток с другой. В результате диполь-дипольных взаимодействий возникают слабые связи, называемые ван-дер-ваальсовыми, остаточными или молекулярными.
Ван-дер-ваальсова связь характерна для кристаллов инертно-газовых элементов, широко распространена в качестве одной из основных составляющих в органических соединениях между молекулами. Если она реализуется в структурах минералов, то их кристаллы обладают хорошей спайностью, низкой твердостью. Например, в слоистой структуре графита в слое преобладают ковалентные связи, а между слоями — только ван-дер-ваальсовы, что объясняет совершенную спайность, параллельную графитовым слоям. Ван-дер-ваальсовы связи на полтора порядка слабее ковалентных и ионных. Они быстро ослабевают с увеличением межатомных расстояний, но тем не менее в кристалле любого типа всегда присутствуют в качестве добавочных. Для кристаллов с чисто ван-дер-ваальсовыми связями характерны летучесть, легкоплавкость (точка плавления не больше 300° С), отсутствие электро- и теплопроводности и др.
Водородная связь. Помимо четырех основных типов выделяют специфическую разновидность химической связи — водородную связь, хотя она и не является пятым типом связи. Энергия ее невелика: примерно в десять раз превышает ван-дер-ваальсову, но на порядок слабее ковалентной.
Водородная связь — это связь, которую атом водорода образует с двумя электроотрицательными атомами, такими как О, F, N, Сl. Механизм связи состоит в том, что атом Н, отдав свой единственный электрон одному из электроотрицательных атомов (например, О1) и, следовательно, лишившись электронной оболочки, по размерам оказывается исчезающе малым и может быть втянут в электронную оболочку другого ближайшего атома (например, О2) до тех пор, пока силы отталкивания между протоном Н+ и ядром атома кислорода О2 не придут в состояние равновесия. В результате между атомами О1 и О2 возникает связь, передатчиком которой служит атом водорода, — водородная связь: О1-Н-О2. С химической точки зрения она близка к одной из разновидностей ионной связи. Однако в отличие от нее водородная связь является направленной, т. е. сохраняет черты ковалентной связи.
В итоге можно отметить, что ионная, металлическая и ван-дер-ваальсова связи не являются направленными. Это указывает на то, что электронная плотность вокруг атомов приблизительно сферически симметрична. Ковалентная и водородная связи, напротив, являются направленными, и максимум электронной плотности лежит на линии, соединяющей взаимодействующие атомы.